Tracce per lo studio – Peso dell'aria e Leggi dei Gas
Il peso dell'aria (link)
L'aria è un fluido e ha un peso (7):
Le molecole sono molto piccole; in un cm cubo ne troviamo circa 10 quintilioni; quante sono? Potremmo usare il paragone degli insetti (15);
Le molecole urtano qualsiasi cosa (16) : questa è la pressione (l'insieme di questi urti).
Nonostante la quantità di aria che ci pesa addosso, non rimaniamo schiacciati: perché? Perché i liquidi del nostro corpo contengono gas e i gas hanno pressione anche quando sono disciolti nei liquidi: se la pressione è sufficiente si formano bolle, altrimenti no, ma la il gas “è sempre lì a spingere”, anche se poco.
Questo è il motivo per cui non rimaniamo schiacciati: l'aria che respiriamo “finisce” nei liquidi interni, esercitando verso l'esterno la stessa forza che che dall'esterno tende a schiacciarci (24):
La pressione dell'atmosfera è uniforme e per questo non la avvertiamo (29):
Quando capita, a causa di differenze di temperatura “del clima”, che la pressione dell'atmosfera non sia uniforme, sì generano movimenti d'aria – i venti – che compensano tali differenze, riequilibrando in qualche modo, temporaneamente, la pressione (temporaneamente perché ci saranno sicuramente altri fenomeni ventosi successivi). (31-39)
Il movimento di aria – gas, aeriformi – per effetto di differenze di pressione ci permette di respirare, tra l'altro. (42)
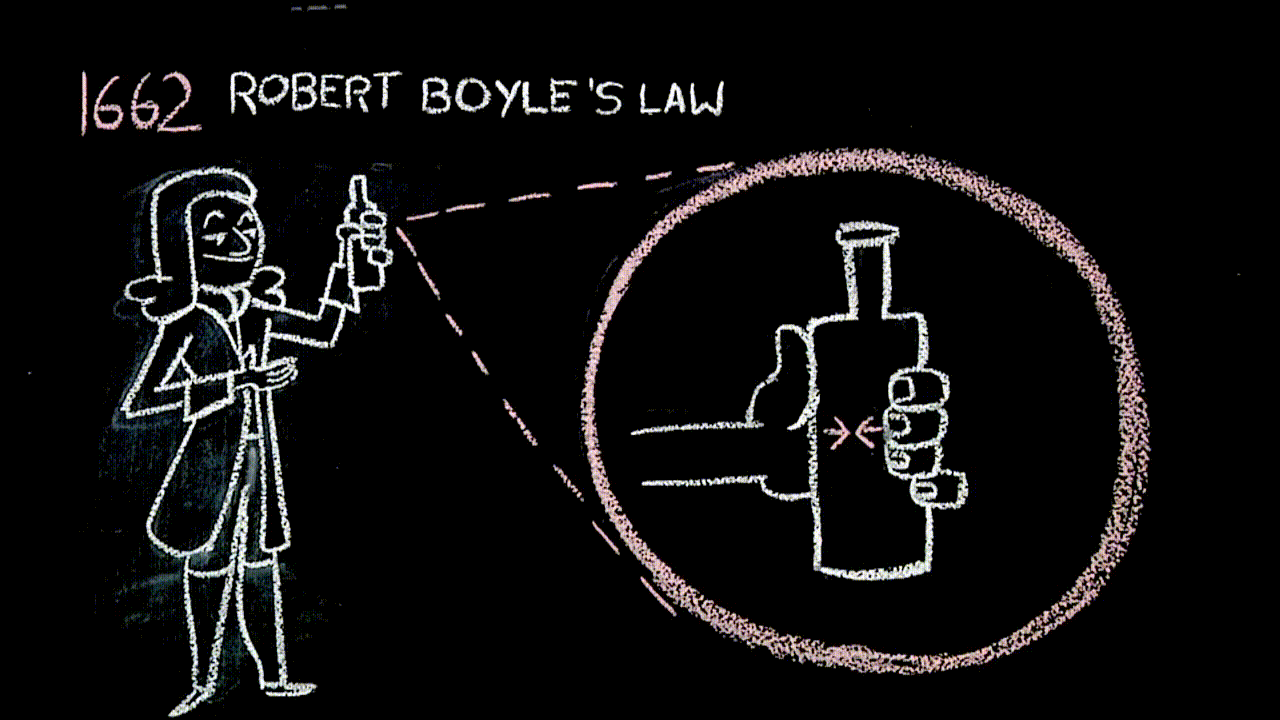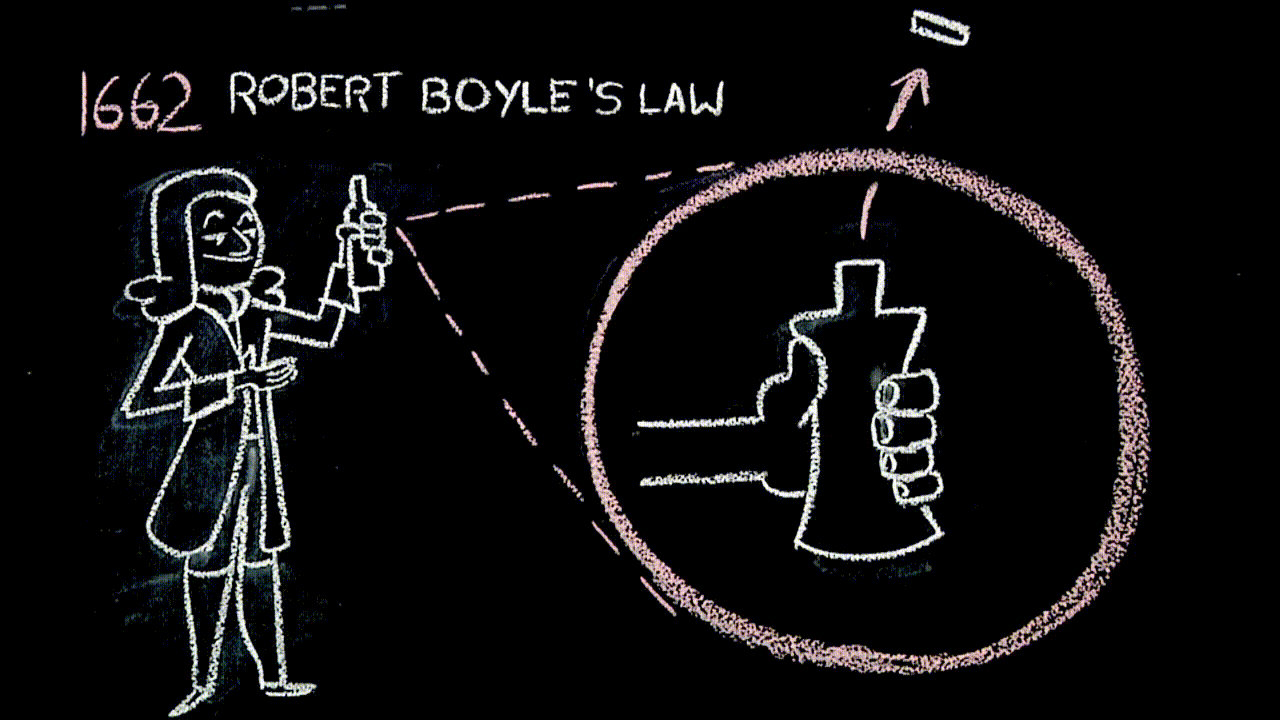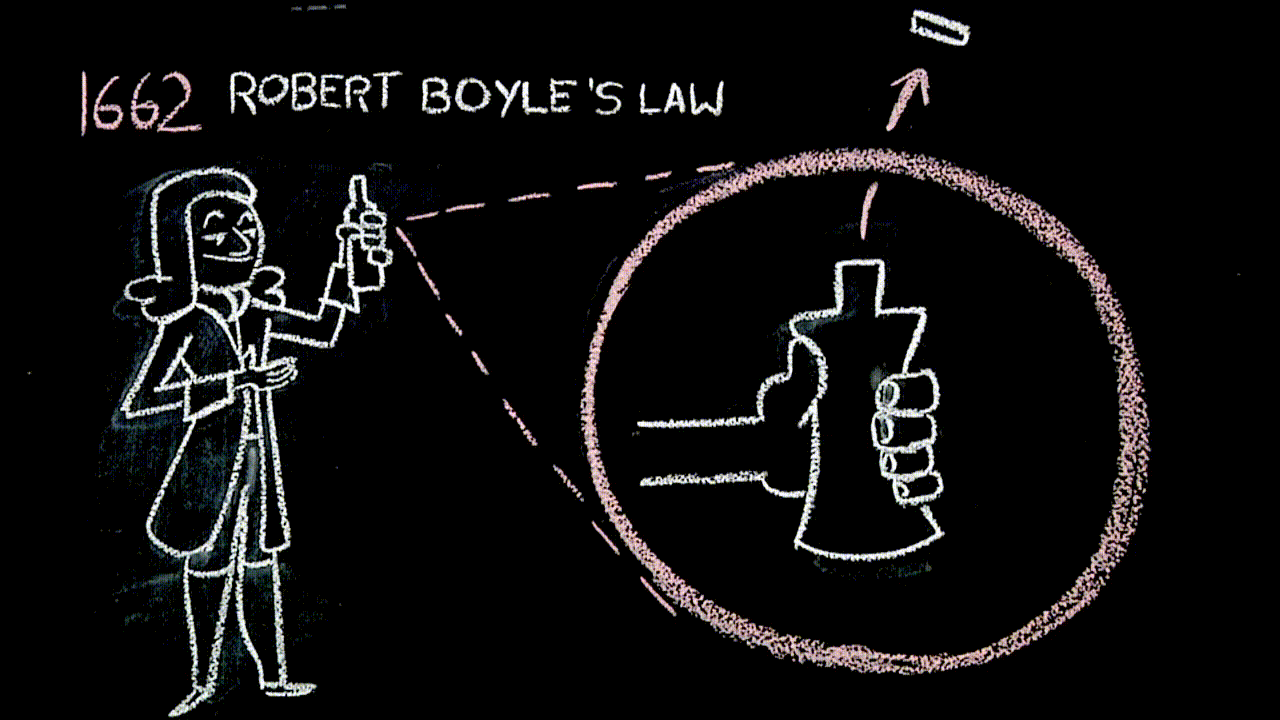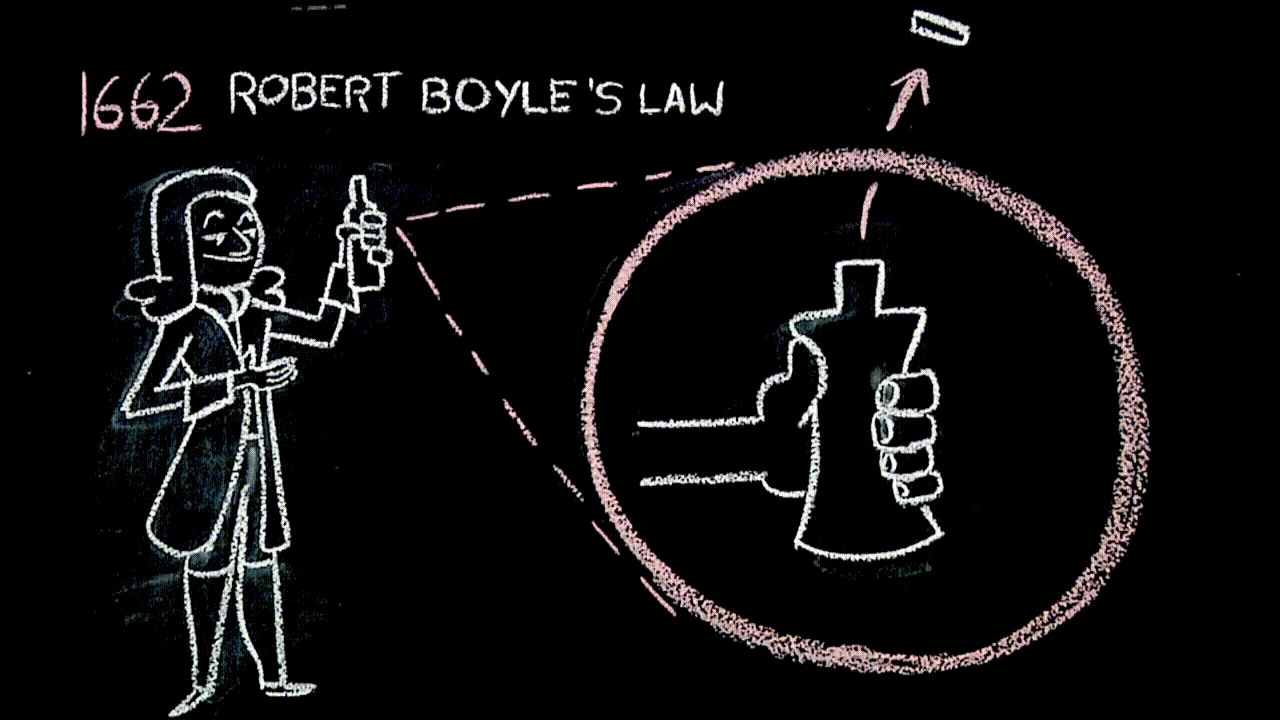
Siringhe e legge di Boyle (link)
L'aria è un fluido elastico (trovate “questa cosa” ai minuti 00:00-02:45, circa).
L'aria ha un peso (03:04-06:30).
Principio di Pascal (06:45-08:35).
Gli emisferi di Magdeburgo (08:35-11:40).
Studi sui motori pneumatici/pompe (11:40-16:15) e l'interpretazione microscopica della natura del gas; uso della pompa a vuoto per lo studio/esperimenti sull'elasticità dell'aria (16:30-19:30).
La legge di Boyle, con la quale il filmato termina, “è uguale” alla figura che abbiamo costruito con i rettangoli che hanno la medesima area: questa parte – da 19:30 in poi – sì può scegliere se approfondire o meno.
Tre leggi sui gas (link):
- alla numero “6” avete la legge di Boyle:
- alla “14” la legge di Charles:
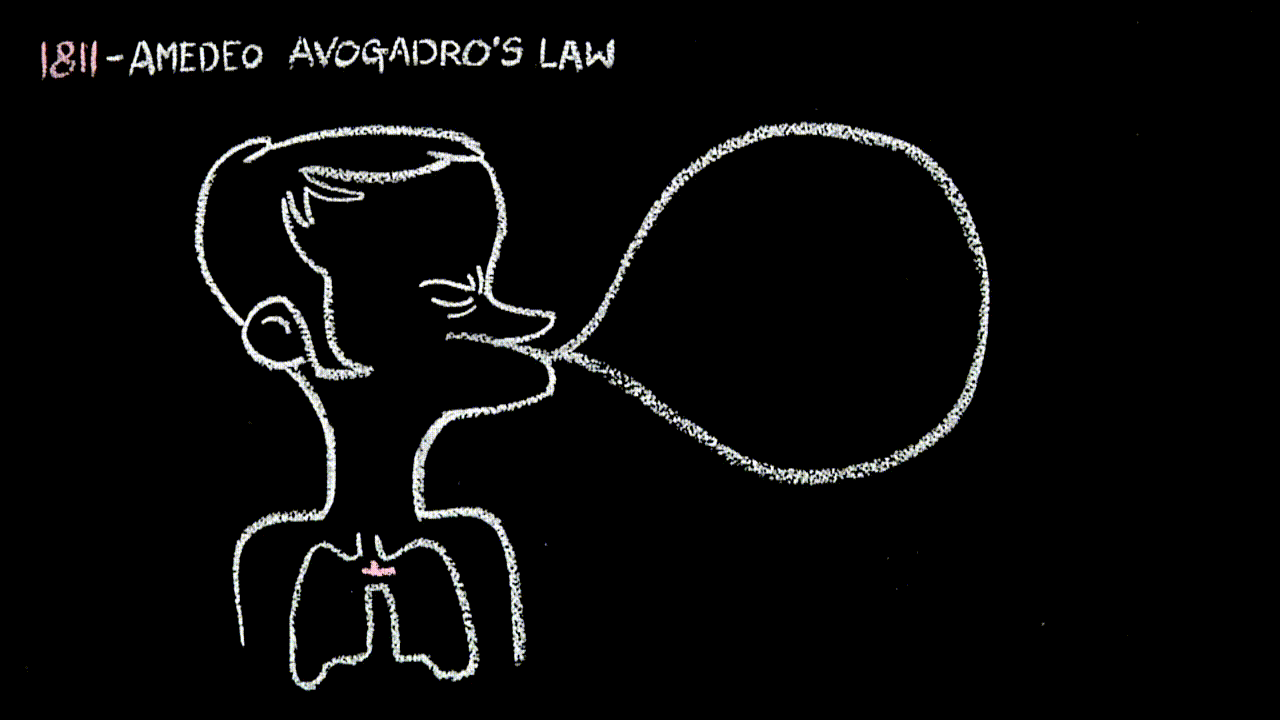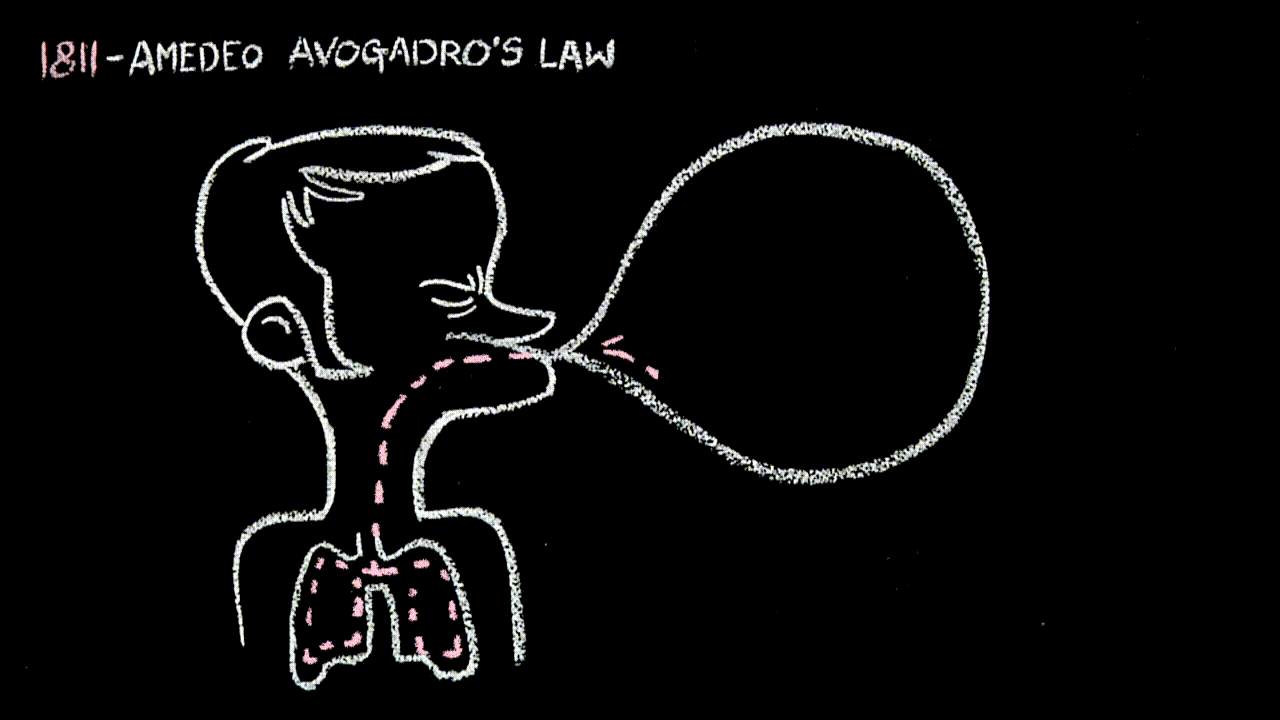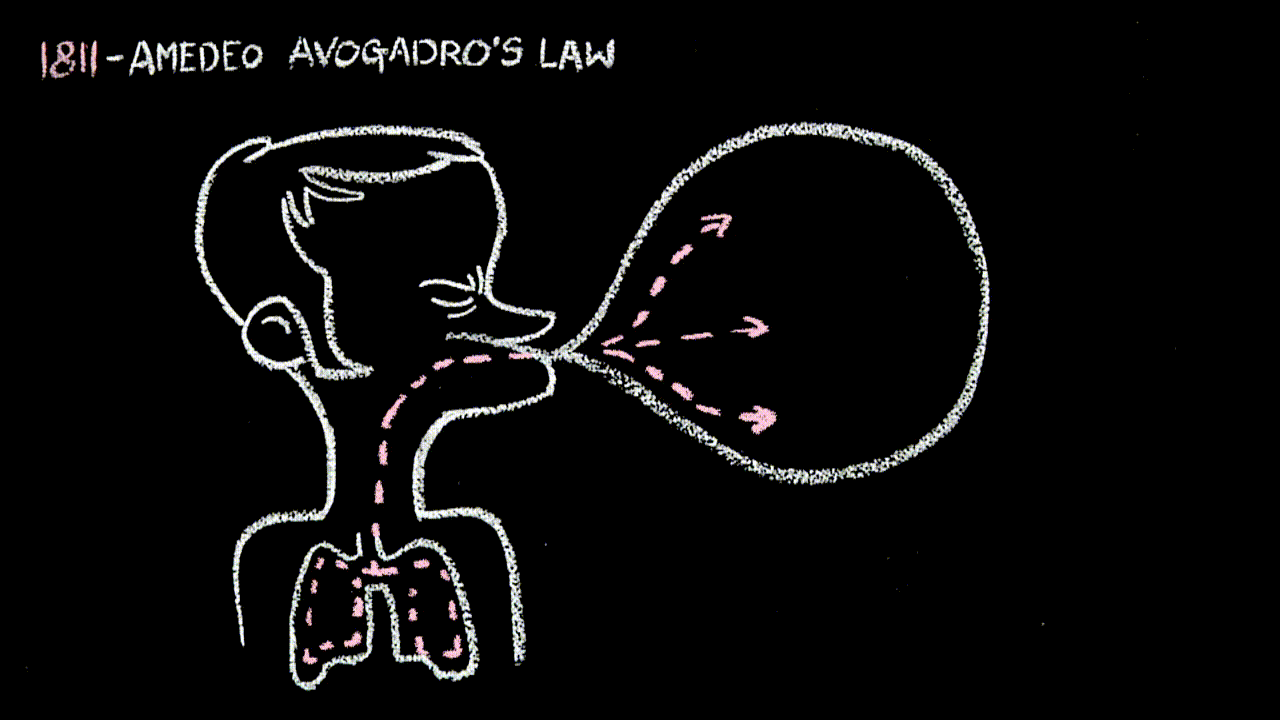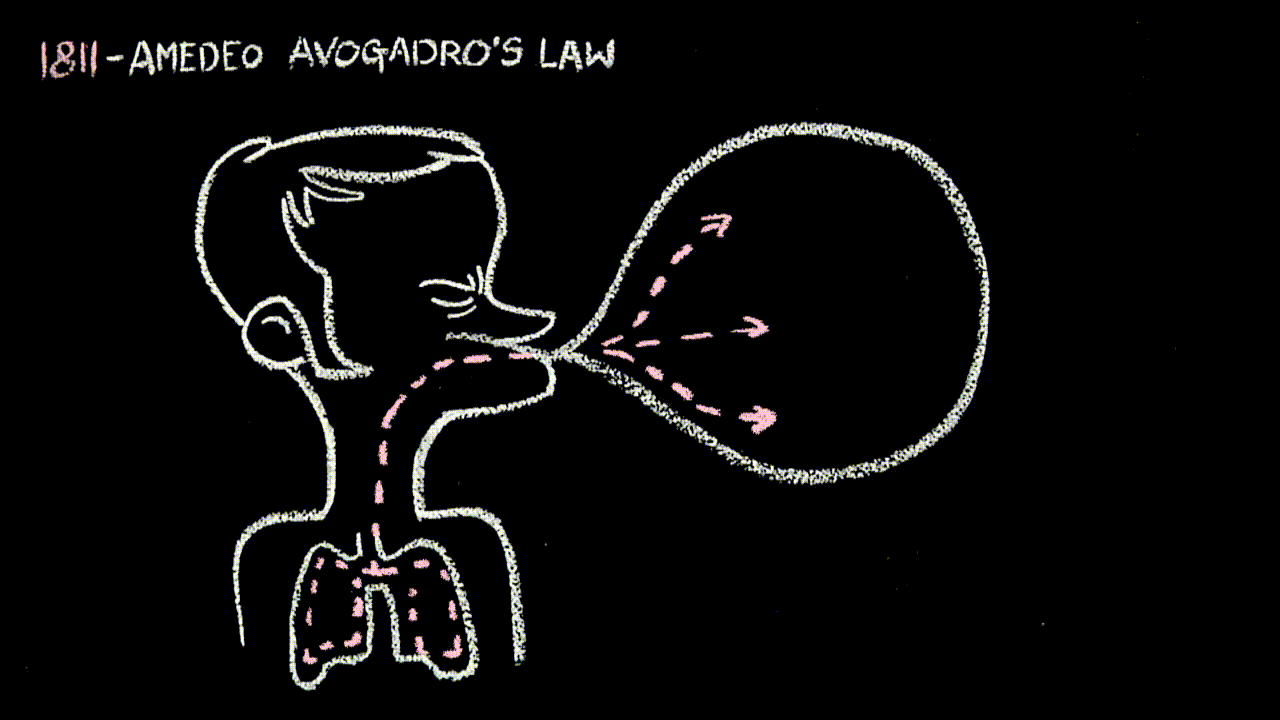
- alla “22” la legge di Avogadro: